      |

生理条件下,大多数蛋白质间相互作用持续时间很短,从而使得相互作用研究变得很困难。交联试剂为这一问题提供了解决方案,即在蛋白质相互作用时将它们共价交联在一起,捕获蛋白质-蛋白质复合物,冻结短暂微弱的相互作用,从而实现对短暂相互作用蛋白的分离和表征。交联过程在体内或体外都可以进行,使用体内还是体外交联取决于项目的需求。两者区别在于,蛋白质在体内交联过程中以天然状态交联,而对于体外交联,蛋白质可能会发生变性。
体内交联
体内交联反应的过程中,蛋白质交联反应发生在细胞内部,因此可以消除假阳性的相互作用及蛋白质复合物稳定性丧失的风险。位于细胞膜内的蛋白质通常使用疏水性和脂溶性交联剂进行交联反应,而位于细胞膜上的蛋白质(如血浆锚定的受体)通常使用亲水性和水溶性交联剂进行交联反应。尽管蛋白质保持天然状态,但由于细胞中蛋白质的复杂性,体内交联的优化过程也可能很复杂,仍然存在发生非特异性交联反应的可能性,可以通过使用间隔臂较短的交联剂来消除非特异性交联的问题。
体外交联
在体外交联过程中,细胞被均质化,裂解。因此,该方法更适合分析较稳定的蛋白质-蛋白质相互作用。由于在特定的裂解缓冲液中对细胞进行裂解,想要对反应条件进行控制变得比较容易,如温度、pH、离子强度等反应条件都可以进行调整。因为不在受到体内环境的限制,也有更多类型的交联剂可供选择,也可以更好的控制非特异性交联。

交联法蛋白质相互作用分析
化学交联
化学交联剂通过在两个或多个生物分子的特定氨基酸官能团之间形成化学键而将相互作用的蛋白质、结构域或多肽共价连接在一起,这些分子由于相互作用而紧密相邻。根据项目的具体要求,许多商业化的化学交联剂可供选择,包括同源双功能或异源双功能交联剂,长臂或短臂交联剂,可裂解或不可裂解交联剂,水溶性或非水溶性交联剂等等。同源双功能分子靶向蛋白质上相同的功能基团,而异源双功能交联剂能够靶向不同蛋白质上的不同官能基团,可以实现更大的变异性或特异性交联。交联剂分子也可以设计成包含可裂解的元素,如酯或二硫键,以分别通过添加羟胺或还原剂来逆转或破坏连接。疏水性的交联剂,可以进入疏水性蛋白质结构域或穿过细胞膜;亲水性的交联剂,可以限制交联至水性环境。
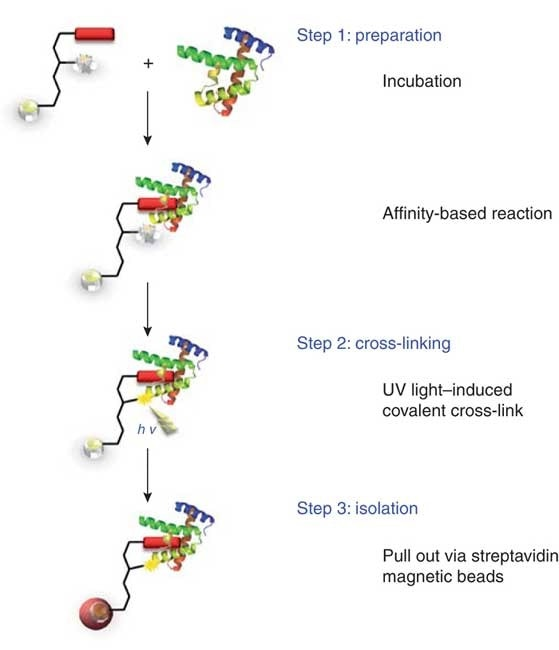
光敏交联
由于将交联剂添加到细胞悬液或细胞裂解物中可能导致许多非特异性交联的形成,为了更好的分析蛋白质-蛋白质的相互作用,还通过添加光敏基团等方式,设计了更复杂的交联剂。这些光敏基团仅在选定的时间内发生反应,并仅对紫外线照射发生响应。一端具有化学交联基团而另一端具有光敏基团的异源双功能交联剂可通过两个步骤与选择的目标蛋白发生反应。
• 可对体内瞬时蛋白质间相互作用进行分析
• 可对低亲和力的体外蛋白质间相互作用进行分析
• 高检测灵敏度
1. 根据您的特定项目需求设计交联方法和交联剂类型:体内/体外;
2. 反应条件优化,有针对性的结合样品特性及项目需求,对实验条件进行优化;
3. 细胞裂解,CoIP;
4. 蛋白免疫印迹/质谱分析(根据项目需求而定);
5. 数据分析及报告交付。
您只需下单-寄送样品
百泰派克一站式服务完成:样品处理-上机分析-数据分析-项目报告
